A Covid eltörpül ahhoz a pusztításhoz képest, amit az antibiotikumra rezisztens baktériumok okoznak majd
Az antibiotikumra rezisztens törzsek mára sarokba kényszerítették az egészségügyi ellátókat, akik kénytelenek kombinált terápiákat alkalmazni ellenük, vagyis több gyógyszerrel kezelik egyszerre a bakteriális fertőzéseket. Mennyire fenntartható ez a módszer? Sajnos a megfigyelések alapján nem nagyon: a kutatók kifejlesztenek egy új antibiotikumot, amire a baktérium szépen ellenállóvá válik – így alakul ki egy végeláthatatlan versenyfutás. Idővel pedig a kombinált gyógyszerek is jócskán vesztenek a hatásosságukból, hamarosan pedig elfogynak a lehetőségeink.
Ha pedig minden marad változatlan, akkor 2050-re katasztrófa fog ezen a téren bekövetkezni: a rezisztens törzsek éves szinten 10 millió ember halálát okozzák majd. Csak hogy kontextusba helyezzük: a jelenlegi világjárvány áldozatainak száma 5 milliónál tart globálisan, ami borzalmas veszteség, de eltörpül ahhoz a pusztításhoz képest, amire az antibiotikumainkra rezisztens baktériumok lesznek majd képesek nem is olyan sokára.
Természetesen akadnak ígéretes új módszerek mind a gyógyszerek között, mind pedig a jelenlegi eszközök racionálisabb felhasználásában, de azért azt sem ártana tudni, hogy pontosan milyen mechanizmusok útján válnak a baktériumok ellenállóvá, hogy ezeket feltérképezve próbáljuk meg a jelenlegi gyógyszereket ismét hatásossá tenni. Egy új kutatás célja pedig éppen ez.
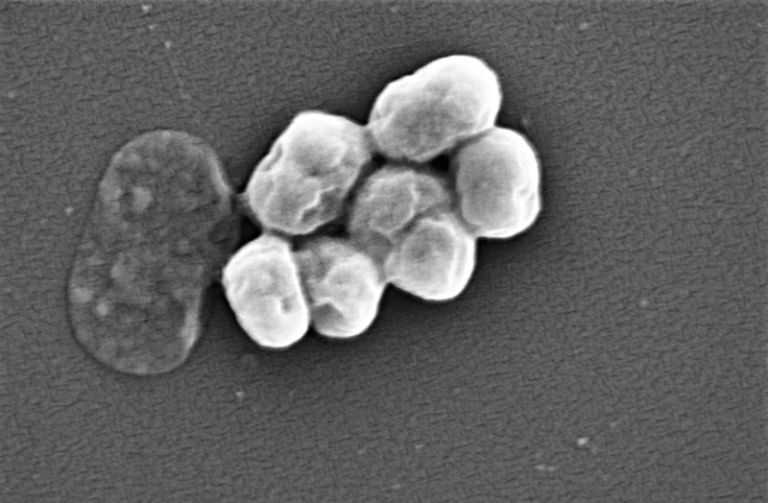
A tudósok az A. baumannii-t kezdték el vizsgálni, mivel ez a baktérium mostanra a világon és Európa számos országában jelentős egészségügyi problémákat okoz kórházi fertőzések formájában. Az A. baumanii az 1980-as évektől okozott kórházi járványokat Európa nyugati felén, és azóta az ilyen fertőzések száma világszerte növekszik. A leginkább az intenzív terápiás osztályokon jellemző és egyebek mellett húgyúti fertőzést, másodlagos meningitist vagy pneumoniát okozhat – egy hazai vizsgálat szerint az intenzíveken a környezeti mintákban azonosítottakon belül ez a második leggyakoribb kórokozó. További rossz hír az A. baumannii kapcsán, hogy az összes, az általa okozott fertőzések kezelésére alkalmazott antibiotikum csoporttal szemben ellenálló lehet.
Azt már korábbi vizsgálatok is kiderítették, hogy amint a baktérium „veszélyben érzi magát”, tehát például a környezetében megjelenő antibiotikum hatására megváltoztatja a sejfalának a szerkezetét, hogy ellenállóvá váljék a gyógyszerel szemben. Lényegében tehát visszahúzódik a várfal védelme mögé, és így képes túlélni kedvezőtlen körülmények közt is elég sokáig. Ráadásul ezelatt az idő alatt sem üldögél tétlen, hanem a baktériumban ekkor kialakul egy tényleges rezisztencia az antibiotikummal szemben, ami miatt a gyógyszeres terápiák csődöt mondanak. Mindez a folyamat az antibiotikum megjelenését követően akár 24 órán belül is képes lezajlani.
A mostani kutatás tehát ezekre az eredményekre épül, és azt próbálják beazonosítani, hogy a sejtfal miféle változásai teszik ennyire ellenállóvá ezt a kórokozót, valamint, hogy ez a túlélési fázis miként járul hozzá a valódi rezisztencia kialakulásához. Az első lépés tehát annak a kiderítése, hogy melyik környezeti hatás váltja ki pontosan a sejtfal védelmét. Ennek érdekében DNS-szerkesztéssel úgy alakították át a kórokozót, hogy amint a környezeti hatásokra megváltoztatná a sejtfalát, kékké válik, így pedig lehetőség nyílik a változás pontos megfigyelésére. Most tehát különböző antibiotikumoknak, változó hőmérsékletnek és különböző savasságú környezetnek, valamint tápanyagmegvonásnak teszik ki ezt a kórokozót, hogy megfigyeljék, mikor indul be az A. baumannii fentebb kifejtett védelmi mechanizmusa.
A remények szerint így sikerül új célpontokat megállapítani a baktérium felszínén, amit az antibiotikumok megtámadhatnak, ennek köszönhetően pedig a már meglévő gyógyszerek hatékonyságán is lehet majd javítani.
(Fotó: A.baumannii pásztázó elektronmikroszkópok felvétele, wikimedia commons/ Vader1941)